治験管理室
調査開始までの流れ
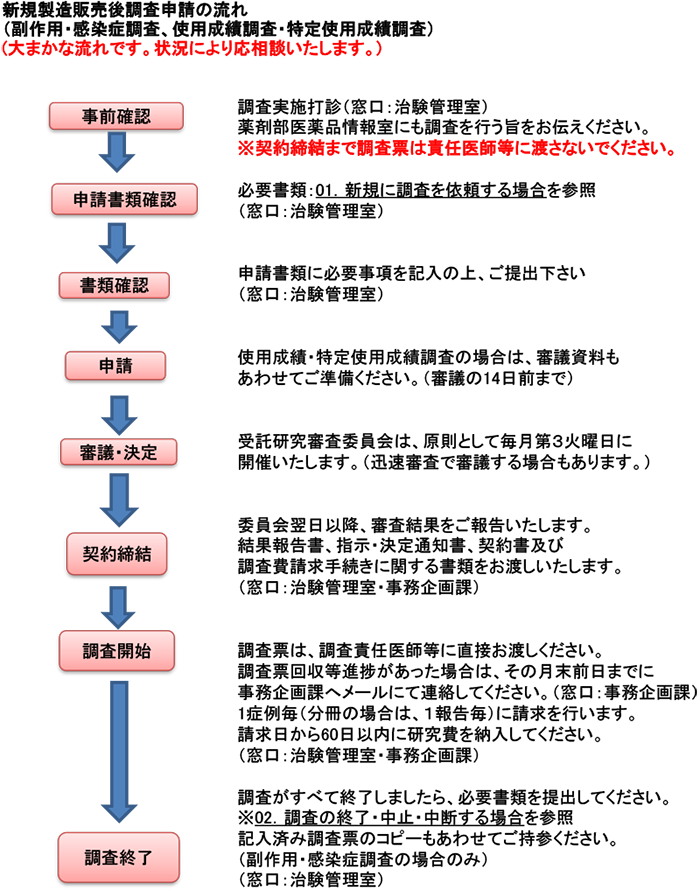
製造販売後調査
※下記一覧より該当するケースをクリックしてください
ご不明な点がございましたら治験管理室までご連絡ください。 TEL.078(791)0111(代表)
01.新規に調査を依頼する場合
02.調査の終了、中止、中断する場合
03.調査責任医師・調査分担医師を変更する場合
04.契約症例を変更(増減)する場合
05.実施期間を延長又は短縮する場合
01. 新規に調査を依頼する場合
| 様式 |
書式タイトル |
原本作成部数 |
| 1 |
研究委託申込書 |
1 |
| 2 |
受託研究申請書 |
1 |
| 3 |
受託研究審査依頼書 |
1 |
| 4 |
受託研究審査結果通知書 |
1 |
| 5 |
受託研究に関する指示・決定通知書 |
2 |
| 6-1 |
受託研究(製造販売後調査)契約書 |
2 |
| 11 |
受託研究分担医師リスト |
1 |
| |
研究費執行計画書 |
1 |
| |
上記書類をまとめてダウンロード |
 |
受託研究審査用資料(以下の資料を各1部ファイルしたもの15部)
01.調査実施計画書(作成した場合)
02.調査票の見本
03.添付文書
04.同意・説明文書の案(同意が必要な場合)
02. 調査の終了、中止、中断する場合
| 様式 |
書式タイトル |
原本作成部数 |
| 8 |
受託研究終了(中止・中断)報告書 |
1 |
| 9 |
受託研究終了(中止・中断)に関する通知書 |
2 |
| |
調査票(提供データ)(副作用詳細調査のみ)の写し |
1 |
| |
上記書類をまとめてダウンロード |
 |
03. 調査責任医師・調査分担医師を変更する場合
| 様式 |
書式タイトル |
原本作成部数 |
| 10 |
受託研究に関する変更申請書 |
1 |
| 11 |
受託研究分担医師リスト |
1 |
| |
上記書類をまとめてダウンロード |
 |
04. 契約症例を変更(増減)する場合
| 様式 |
書式タイトル |
原本作成部数 |
| 6-2 |
契約内容に関する覚書 |
2 |
| 10 |
受託研究に関する変更申請書 |
1 |
| |
研究費執行計画書 |
1 |
| |
上記書類をまとめてダウンロード |
 |
05. 実施期間を延長又は短縮する場合
| 様式 |
書式タイトル |
原本作成部数 |
| 6-2 |
契約内容に関する覚書 |
2 |
| 10 |
受託研究に関する変更申請書 |
1 |
| |
上記書類をまとめてダウンロード |
 |


